
更新情報
news
![]() 株式会社 新薬リサーチセンターby トランスジェニックグループ
株式会社 新薬リサーチセンターby トランスジェニックグループ

更新情報
news
| 2017年08月01日 | ||||||||||||||||||
| 各位 | ||||||||||||||||||
| 株式会社新薬リサーチセンター 代表取締役社長 福永 健司 |
||||||||||||||||||
| 精神・神経疾患モデルマウスに関するライセンス契約締結のお知らせ | ||||||||||||||||||
| 当社グループは、遺伝子改変モデルマウスを用いた中枢神経系非臨床試験受託サービスを開始いたしますのでお知らせいたします。 【概 要】 当社グループ会社の株式会社トランスジェニックは創業以来、遺伝子改変マウス作製を基幹事業とし、それに関わるマウス作製、系統保存、増産のサービス、各種モデルマウス販売のサービスを提供してきました。また、当社は豊富な経験とノウハウを活かし、GLP適合施設での非臨床試験及びGCPに対応した生物学的同等試験等の食品臨床試験受託サービスを提供しています。 このような両社の特色を活かして協業で、アルツハイマー病、認知症、精神・神経疾患について、それぞれ特色をもつ病態モデルマウスを用いた各種行動試験により、中枢神経系の薬効を評価いたします。 <モデルマウス>
※組織学的、生化学的解析も可能です。試験内容はご相談ください。 アルツハイマー病モデルマウスアルツハイマー病は認知機能低下を主な症状とする進行性の神経変性疾患で、その特徴的な脳内病理変化として、アミロイドβ (Aβ)の不溶性凝集体の蓄積である老人斑の形成、タウタンパク質の不溶性凝集体の蓄積である神経原線維変化 (neurofibrillary tangle、NFT) の形成、脳萎縮が知られています。アルツハイマー病の発症機序を説明するものとして、下記のようなアミロイド仮説が知られています。 1. Aβが自己凝集によって可溶性凝集体(Aβオリゴマー)や不溶性凝集体(Aβフィブリル)を形成する。 2. Aβ凝集体がタウタンパク質の過剰なリン酸化と自己凝集を誘導し、異常な凝集タウであるNFTを形成する。 3. NFTが神経細胞死を誘導する。 4. 脳萎縮が進行し、認知障害が生じ、アルツハイマー病を呈する。 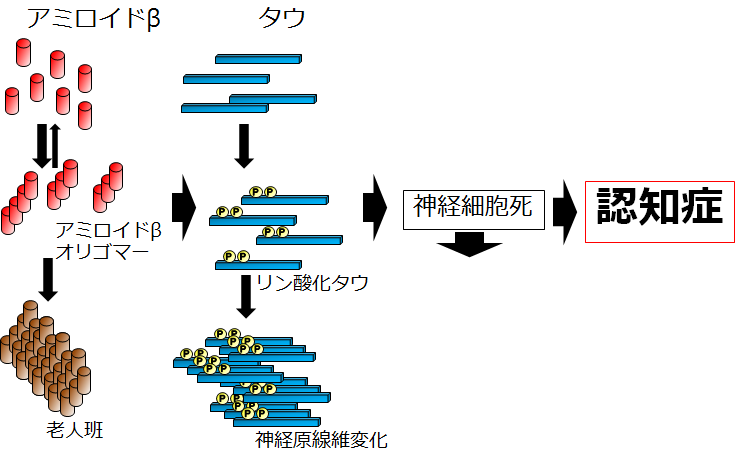 初期のアミロイド仮説においては老人斑中の不溶性凝集体であるAβフィブリルによる神経細胞死によって認知機能低下が引き起こされていると考えられていました。その後、細胞死誘導に必要なAβ濃度が生体内の条件に比べて高すぎること、アルツハイマー病患者の疾患重篤度が脳内のAβフィブリルの量とは相関していないことから、Aβフィブリル以外のものが毒性を持っている可能性が示唆されました。そして、生理的な濃度でシナプス機能の障害を引き起こすAβオリゴマーが病態の発症に重要ではないかと考える「オリゴマー仮説」が提唱されました。しかし、アルツハイマー病患者の脳内にはAβオリゴマーと同様にAβフィブリルも存在することから、どちらがアルツハイマー病発症に寄与しているのかを検証するかは難しい問題でした。 大阪市立大学の富山貴美先生、森啓先生らのグループは、2008年に家族性アルツハイマー病の新しい遺伝子変異を報告しました(1)。Osaka変異と名付けられたこの遺伝子変異は、アミロイド前駆体タンパク質(amyloid precursor protein; APP)における1アミノ酸の欠失型変異でした(APPOSK; E693Δ)。APPOSKから産生されるAβは1アミノ酸を欠失した変異型Aβ(E22Δ)となり、Aβフィブリルを形成せず、Aβオリゴマーを非常に多く形成するという特徴を有していました。Osaka変異を持つアルツハイマー病患者の脳には老人斑が検出されず、この発見によって、Aβオリゴマーのみでアルツハイマー病が発症することが初めて証明されました。 APPOSK変異タンパク質をマウス脳内で発現するトランスジェニックマウスがAPPOSK-Tgマウスです(2)。APPOSK-Tgマウスでは、加齢に伴って脳内にAβオリゴマーの蓄積が検出されますが、24ヵ月齢においても老人斑は全く見られません。しかしこのマウスでは、シナプス消失、タウの異常リン酸化、グリア細胞の活性化、神経細胞死といった多くのアルツハイマー病の病理が見られます。このことから、APPOSK-Tgマウスは、Aβオリゴマーがアルツハイマー病理を引き起こすオリゴマー仮説を支持するモデルであるとともに、Aβオリゴマーによるアルツハイマー発症の病態とそれをターゲットとする治療法、創薬の研究に役立つものと考えられます(3)。 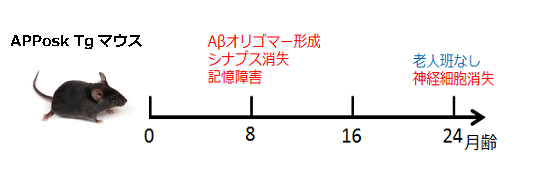 ◆APPOSKマウスの記憶評価及びAβオリゴマー免疫染色 <水迷路試験> (当社取得データ) 使用動物: C57BL/6マウス(n = 6)、10か月齢 APPOSKマウス (n = 8)、 9~10か月齢  平均値±標準誤差を表す * p<0.0、** p<0.01、C57BL/6群と比較してt検定で有意差あり <β-amyloid oligomer 染色(NU-1抗体を用いた免疫染色)> Non-Transgenicマウス 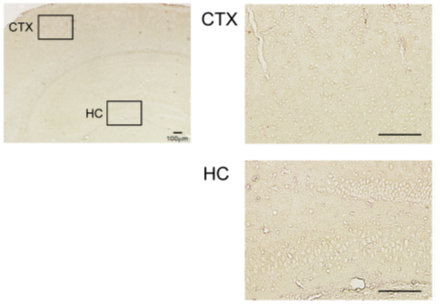 APPOSKトランスジェニックマウス 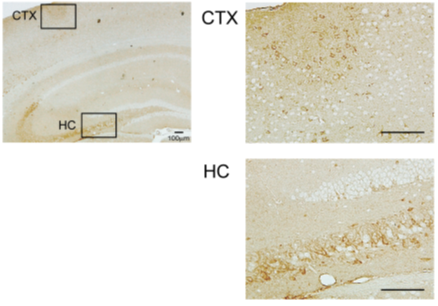 <文献> (1) Tomiyama T., Nagata T., Shimada H., Teraoka R., Fukushima A., Kanemitsu H., Takuma H., Kuwano R., Imagawa M., Ataka S., Wada Y., Yoshioka E., Nishizaki T., Watanabe Y., Mori H. A new amyloid β variant favoring oligomerization in Alzheimer's-type dementia. Ann. Neurol. 63, 377-387 (2008). (2) Tomiyama, T., Matsuyama, S., Iso, H., Umeda, T., Takuma, H., Ohnishi, K., Ishibashi, K., Teraoka, R., Sakama, N., Yamashita, T., Nishitsuji, K., Ito, K., Shimada, H., Lambert, M.P., Klein, W.L. and Mori, H. A mouse model of amyloid β oligomers: Their contribution to synaptic alteration, abnormal Tau phosphorylation, glial activation, and neuronal loss in vivo. J. Neurosci. 30, 4845-4856 (2010). (3) Umeda T., Ono K., Sakai A., Yamashita M., Mizuguchi M, Klein W.L., Yamada M., Mori H., Tomiyama T. Rifampicin is a candidate preventive medicine against amyloid β and tau oligomers. Brain 139, 1568-1586 (2016). <特許> ■特許第4776544号「変異型アミロイドタンパク質」 認知症モデルマウス認知症にはアルツハイマー病以外にも様々なものが知られているが、そのうち「第17染色体遺伝子に連鎖しパーキンソニズムを伴う家族性前頭側頭葉認知症 (Frontotemporal dementia and parkinsonism linked to chromosome 17; FTDP-17)」は常染色体優勢で遺伝することが知られる疾患です。FTDP-17は運動障害並びに認知機能障害が通常40~60歳で発症し、一定年数の間で深刻な認知症に進展することが知られています。FTDP-17はタウタンパク質の異常によるものであることが知られています。タウタンパク質の異常蓄積は神経死に直接関連していると考えられており、アルツハイマー病の原因とも考えられています。FTDP-17においてタウタンパク質における遺伝子変異は複数報告されていますが、その一つがpoint mutationでアミノ酸置換が起こるN279K変異です。このN279K変異を持つタウタンパク質をマウスの脳内で発現させたのがSJLBマウスです。このマウスでは空間学習、恐怖の学習能力が低下しており、認知障害のモデル動物として、タウをターゲットとした認知症の治療法、創薬の研究に役立つものと考えられます。 <文献>> Taniguchi, T., Doe, N., Matsuyama, S., Kitamura, Y., Mori, H., Saito, N. and Tanaka, C. Transgenic mice expressing mutant (N279K) human tau show mutation dependent cognitive deficits without neurofibllary tangle formation. FEBS letters 579, 5704-5712 (2005). <特許> ■JP2011043428A「非ヒトモデル動物を用いたパーキンソン症候群の検査方法」 精神・疾患モデルマウス神経栄養因子の一つである脳由来神経栄養因子 (BDNF: brain-derived neurotrophic factor)は、うつ病をはじめとした様々な精神・神経疾患に関与するものとして近年注目されています。BDNFは脳内における神経回路網の形成や発達、さらにその生存に重要であることまた、シナプスの可塑性にも関与し記憶や学習の形成において重要な役割を果たしていることが示されてきています。BDNFは前駆体であるproBDNFからプロテアーゼによって切断され、成熟型のBDNF (mature BDNF)が生成されます。matureBDNFはチロシンキナーゼ受容体 (TrkB) に結合し、細胞生存、細胞分化、シナプス形成などを誘導しますが、proBDNFはp75NTR受容体へ結合し、アポトーシス、神経突起伸長抑制などをもたらします。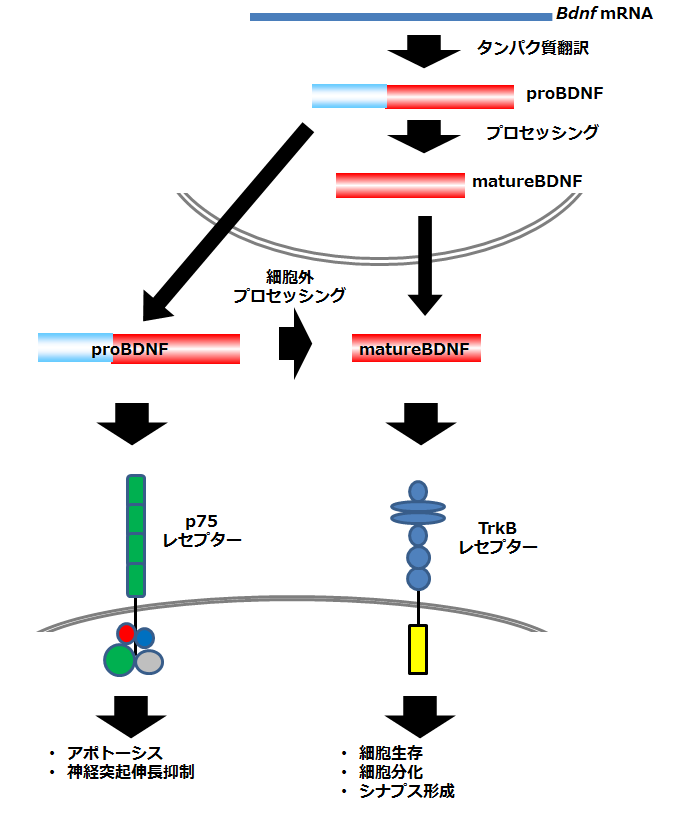 このことから、産業技術総合研究所の小島正巳先生らは、proBDNFからmatureBDNFへのプロセッシング障害および分泌障害が、精神・神経疾患に関与するのではないかと考え、proBDNFからBDNFへのプロセッシングを抑制する変異を導入したノックインマウスを作製しました。その結果、proBDNFがプロセッシングされないこのマウスは、足のもつれや歩行中に転倒するなどの特徴的な行動異常、オープンフィールドにおける活動量の増大、テールサスペンジョンテストによる無動時間の長期化などが見られました。このことから、本マウスはうつ病をはじめとする精神・神経疾患モデルマウスとして、治療法の開発や創薬に貢献できるものと考えられます。 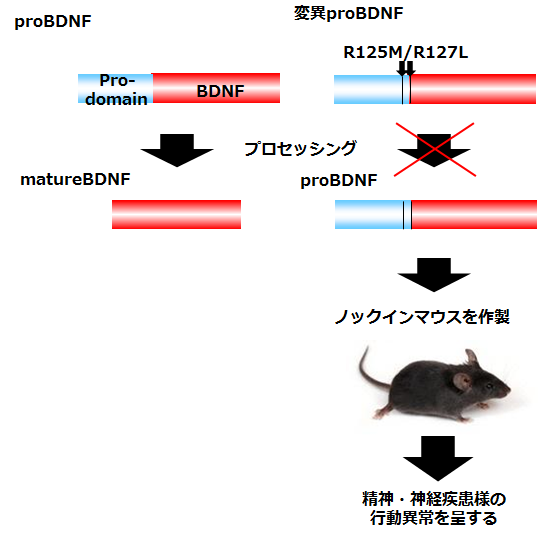 <文献> (1) Mizui, T., Ishikawa, Y., Kumonogoh, H. and Kojima, M. Neurobiological actions by three distinct subtypes of brain-derived neurotrophic factor: Multi-ligand model of growth factor signaling. Phamacol. Res. 105, 93-98 (2016 review). (2) Mizui, T., Ishikawa, Y., Kumanogoh, H., Lume, M., Matsumoto, T., Hara, T., Yamawaki, S., Takahashi, M., Shiosaka, S., Itami, C., Uegaki, K., Saarma, M. and Kojima, M. BDNF pro-peptide actions facilitate hippocampal LTD and are altered by the common BDNF polymorphism Val66Met. Pro. Nat. Aca. Sci. 112, E3067-3074 (2015). (3) Koshimizu, H., Hazama, S., Hara, T., Ogura, A. and Kojima, M. Distinct signaling pathways of precursor BDNF and mature BDNF in cultured cerebellar granule neurons. Neurosci. Letters 473, 229-232 (2010). (4) Koshimizu, H., Kiyosue, K., Hara, T., Hazama, S., Suzuki, S., Uegaki, K., Nagappan, G., Zaitsev, E., Hirokawa, T., Tatsu, T., Ogura, A., Lu, B. and Kojima, M. Multiple functions of precursor BDNF to CNS neurons: negative regulation of neurite growth, spine formation and cell survival. Mol. Brain 2, <特許> ■特許第5414012号 「変異BDNF遺伝子導入ノックインマウス」 |
||||||||||||||||||
| 以上 | ||||||||||||||||||