医薬品開発受託
fiduciary of
nostrum development
![]() 株式会社 新薬リサーチセンターby トランスジェニックグループ
株式会社 新薬リサーチセンターby トランスジェニックグループ

医薬品開発受託
fiduciary of
nostrum development

当社グループ会社の(株)トランスジェニックでは、同社がライセンス許諾を受けて大学や研究機関で樹立されたモデルマウスを販売しています。これらモデルマウスを用いた各種非臨床試験に関するご相談も受け付けておりますので、お気軽にお問合わせください。
| モデルマウス名 | 文献情報 | パンフレット | 価格(税別) |
|---|---|---|---|
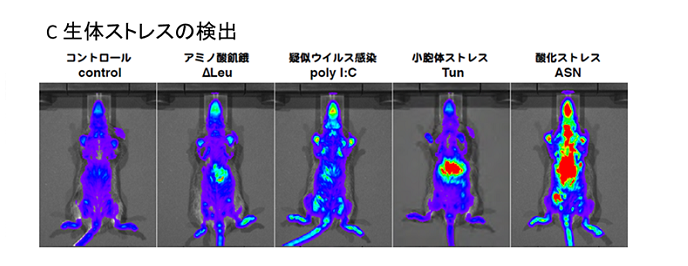
| 生体ストレス可視化マウス (UMAI-Lucマウス) |
Scientific Reports 7, 46230 (2017) | 繁殖許諾権付き1ペア(2匹) \300,000- 個体販売 ¥75,000-/匹 ※可視化マウスについては、 営利企業向けの価格設定がございます |
|
| Tg型小胞体ストレス可視化マウス (ERAI-Lucマウス) |
Nature Medicine 10, 98–102 (2004) | ||
| KI型小胞体ストレス可視化マウス (ERAI-Lucマウス) |
|||
| 酸化ストレス可視化マウス (OKD-Lucマウス) |
Scientific Reports 2, 229 (2012) | ||
| 炎症可視化マウス (IDOLマウス) |
Scientific Reports 5, 17205 (2015) | ||
| カテプシンEノックアウトマウス | Carcinogenesis .35, .714–726, (2014) | 準備中 | |
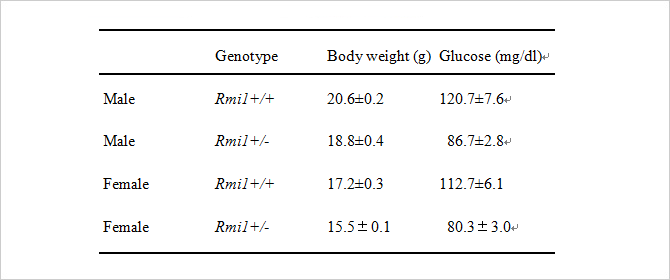
| 肥満抑制モデルマウス (Rmi1トラップマウス) |
FEBS Journal 277 677–686 (2010) | 準備中 | |
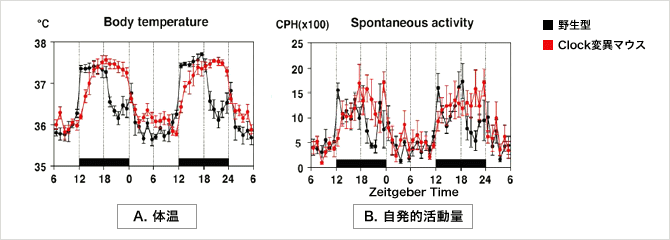
| 夜型モデルマウス (Clock変異マウス) |
Neuroreport 12, 1461-1464 (2001) | ||
| Biochem. Biophys. Res. Commun. 298, 198-202 (2002) | |||
| アトピー性皮膚炎モデルマウス (IL33 Tgマウス) |
PNAS 110, 13921-13926 (2013) | ||
| 赤色蛍光タンパク質発現マウス | ー | 準備中 |
※本製品の使用は、ご購入者の自施設における研究目的に限られています。
※本製品、および、その派生物の第三者への譲渡・配布・再販はご遠慮下さい。
※本製品のご購入の際には、別途、ライセンス確認同意書のご提出をお願いしております。
※ご発注にあたってはライセンス確認同意書の必要事項をもれなくご記入の上、販売店にお渡しください。
※可視化マウスの非臨床試験については、お客様にて検出機器(IVIS Imaging Systemまたはそれに準じたもの)を
ご用意頂く必要がございます。
※可視化マウスに関して、情報交換の場をご提供させていただくため、可視化マウス研究会![]() を設立しております。
を設立しております。
随時、研究会・懇親会を開催しております。詳しくは事務局(当社ジェノミクス事業部)までお問い合わせください。
< 文献 >
■ Iwawaki, T., Akai, R., Toyoshima, T, Takeda, N., Ishikawa, T., Yamamura, K.
Transgenic mouse model for imaging of ATF4 translational activation-related cellular stress responses in vivo.
Sci. Rep. 7, 46230 (2017)
< 文献 >
■ Iwawaki, T., Akai, R., Kohno, K., Miura, M.
A transgenic mouse model for monitoring endoplasmic reticulum stress.
Nat. Med. 10, 98-102 (2004)
< 特許 >
■ 特許第4446057号 「生体刺激存在下でのmRNAのフレームシフトを利用した蛋白質の発現方法」
< 文献 >
■ Oikawa, D., Akai, R., Tokuda, M., Iwawaki, T.
A transgenic mouse model for monitoring oxidative stress.
Sci. Rep. 2, 229 (2012).
< 特許 >
■ WO/2012/099279「酸化ストレスインジケーター発現用核酸構築物とその使用」
< 文献 >
■ Iwawaki, T., Akai, R., Oikawa, D., Toyoshima, T., Yoshino, M., Suzuki, M., Takeda, N., Ishikawa, T., Kataoka, Y., Yamamura, K.
Transgenic mouse model for imaging of interleukin- 1β-related inflammation in vivo.
Sci. Rep. 5, 17205,(2015).
< 特許 >
■ 出願中
細胞内リソソームの蛋白質分解に係わるアスパラギン酸プロテアーゼであるカテプシンEのノックアウトマウスです。Wnt5aのプロセシングを抑制し、高頻度に乳腺腫瘍の形成と悪性化を呈します。
< 文献 >
■ Kawakubo, T., Yasukochi, A., Toyama, T., Takahashi, S., Okamoto, K., Tsukuba, T., Nakamura, S., Ozaki, Y., Nishigaki, K., Yamashita, H., Yamamoto, K.
Repression of cathepsin E expression increases the risk of mammary carcinogenesis and links to poor prognosis in breast cancer.
Carcinogenesis 35, 714–726, (2014).
肥満抑制モデルマウスは TG Resource Bank の中の1系統として、ジーントラップにより樹立されたものです。表現型を解析した結果、雌雄ともに有意な体重の減少と血糖値の低下が認められました。このマウスでは、通常食、高脂肪食を与えた時ともに野生型に比べて有意な体重増加の抑制が見られます。
< 文献 >
■ Suwa, A., Yoshino, M., Yamazaki, C., Naitou, M., Fujikawa, R., Matsumoto, S., Kurama, T., Shimokawa, T., Aramori, I.
RMI1 deficiency in mice protects from diet and genetic-induced obesity.
FEBS J. 277, 677-686 (2010).
体内時計関連遺伝子の1つであるClock遺伝子に変異を有するBALB/c系統の遺伝的バックグラウンドを持つマウスを、Jcl:ICR系統のマウスと戻し交配を繰り返した。その結果、従来のClock遺伝子変異マウスとは異なる以下のような特徴を示す「夜型モデルマウス」が得られた。
下記のような特徴から、日周期リズムの異常メカニズムの解明などに大きく貢献すると期待されます。
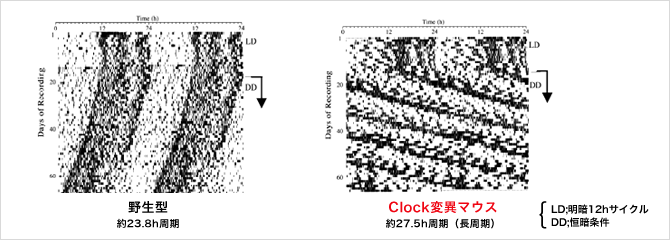
< 文献 >
■ Sei, H,, Oishi, K,, Morita, Y,, Ishida, N.
Mouse model for morningness/eveningness.
NeuroReport 12, 1461-1464 (2001).
■ Oishi, K,, Miyazaki, K,, Ishida, N.
Functional CLOCK is not involved in the entrainment of peripheral clocks to the restricted feeding: entrainable expression of mPer2 and BMAL1 mRNAs in the heart of Clock mutant mice on Jcl:ICR background.
Biochem Biophys Res Commun. 298, 198-202 (2002).
< 特許 >
■ 特開2003-70376 「日周期リズムが夜型を示す動物」
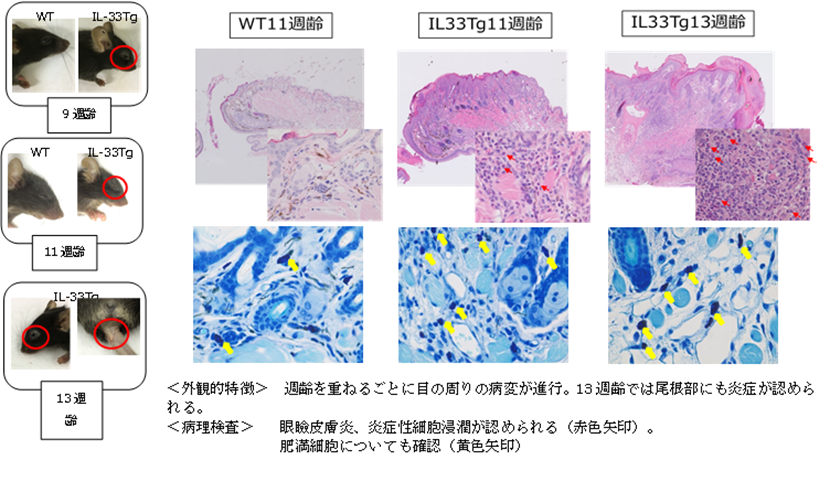
< 文献 >
■ Imai, Y., Yasuda, K., Sakaguchi, Y., Haneda, T., Mizutani, H., Yoshimoto, T., Nakanishi, K., Yamanishi, K.
Skin-specific expression of IL-33 activates group 2 innate lymphoid cells and elicits atopic dermatitis-like inflammation in mice.
Proc. Natl. Acad. Sci. U.S.A. 110, 13921-13026 (2013).
< 特許 >
■ PCT/JP2014/061931「アトピー性皮膚炎モデル動物及びその用途」
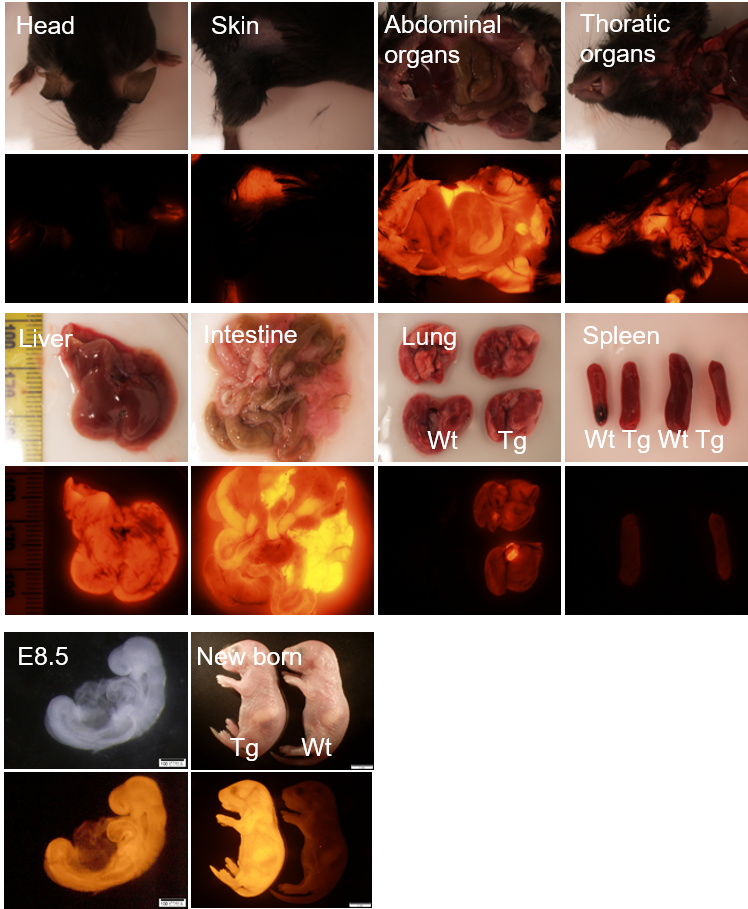
赤色蛍光を発するfresnoRFPを全身で発現するマウスです。蛍光ラベルされた細胞の単離に、また移植実験のドナーとして使用可能です。
・IPフリーのfresnoRFPタンパク質を使用
蛍光タンパク質は様々な波長、強度のものが開発され、使用されていますが、多くのタンパク質ではその使用にライセンスが必要となっています。ATUM社(Newark, CA, USA、https://www.atum.bio/)では、Synthetic Biologyの手法を用いて多数の蛍光タンパク質をコードする遺伝子コレクションを確立し、これらの蛍光タンパク質については知的所有権の制限が設けられておりません。fresnoRFPはその中の赤色蛍光を発するタンパク質のひとつです。本マウスを使用するに当たりまして、購入者が蛍光タンパク質の使用についてライセンスを取得する必要はございません。
fresnoRFPは以下の蛍光特性をもちます。
Ex..max: 553 nm
Em. max: 592 nm
・CAG promoterによる全身での発現
本マウスはfresnoRFPを全身的に発現させるため、CAG promoterを用い、受精卵インジェクションにより当社で作製したトランスジェニックマウスです。図に示すように、各臓器、また胚において蛍光の発現を見ることができます。